Leyes experimentales de los gases ideales
Los gases se caracterizan por expandirse al máximo, por ser compresibles, por mezclarse perfectamente entre ellos y por experimentar grandes dilataciones en respuesta a los cambios de presión y de temperatura. Las magnitudes que permiten estudiar el comportamiento de un gas son:
Presión, P.
En el SI. se mide en pascales (Pa). También se usan atmósferas (1atm= 105 Pa) y milímetros de mercurio (1atm= 760 mmHg).
Volumen, V.
En el SI se mide en metros cúbicos (m3). También se usan litros y submúltiplos.
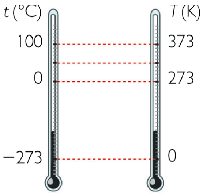
Temperatura absoluta, T.
En el SI se mide en kelvin (K). Se relaciona con la temperatura centígrada según: T(K)=T(ºC) + 273,15.
Cantidad de sustancia, n.
En el SI se mide en moles. El comportamiento de los gases no depende de la masa, sino del número de moles.
